NACA, un guardián molecular que controla la síntesis de proteínas
Tabla de contenido

En un artículo firmado por Peter Rüegg, Corporate Communications de la ETHZ, se recuerda que las fábricas de proteínas de nuestras células, los llamados ribosomas, tienen una tarea central: durante un proceso llamado traducción, los aminoácidos se unen entre sí mediante el ARN mensajero, formando una cadena peptídica en crecimiento que luego se pliega en una proteína funcional.
¿Qué es NACA y por qué es importante? #
Este coordinador es un complejo proteico conocido por los expertos como complejo asociado a polipéptidos nacientes (NACA). Sin NACA, estas modificaciones tempranas se vuelven ineficientes o erróneas.
Desde su descubrimiento hace unos 30 años, las funciones de NACA han permanecido inciertas. Sin embargo, trabajos recientes del laboratorio del biólogo Nenad Ban, de la ETH, muestran cómo NACA regula la maduración de las proteínas al reclutar enzimas específicas precisamente cuando y donde se necesitan.
Ribosomas en acción
NACA consta de dos proteínas que forman un núcleo central en forma de bola con cuatro extensiones altamente flexibles, lo que le da una apariencia similar a la de un pulpo a nivel molecular. Uno de estos brazos ancla NACA al ribosoma. Los otros tres pueden unirse a una amplia gama de enzimas y otros factores moleculares involucrados en la producción de proteínas, incluida una molécula que dirige las proteínas específicamente para su inserción en las membranas (ver el siguiente gráfico).
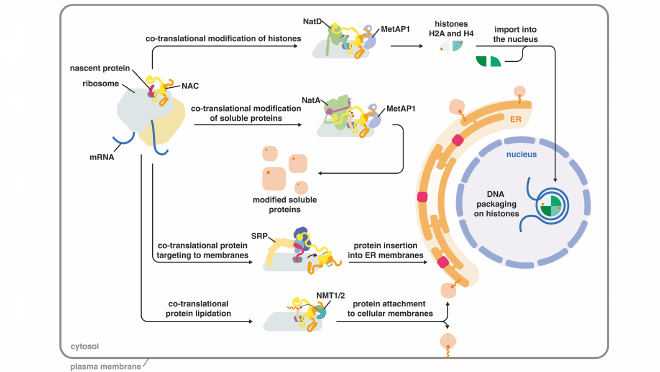
Capturar las enzimas adecuadas en el momento justo #
Pero esto no es todo lo que NACA puede hacer. En su nuevo estudio, recién publicado en Science Advances, Ban y sus colegas de las Universidades de Constanza, Alemania, y Caltech revelaron una función previamente desconocida: cómo NACA asegura la correcta modificación química de las histonas H4 y H2A mientras aún se están sintetizando.
En su estudio, los investigadores demuestran que NACA lleva dos enzimas al ribosoma para, primero, eliminar el primer aminoácido de la proteína histona y, luego, modificar el extremo recién expuesto con un grupo químico acetilo. Dado que las histonas se ensamblan muy rápidamente, estos dos pasos de procesamiento deben ocurrir en la secuencia correcta y casi instantáneamente.
“En el caso de las histonas, el margen temporal para las modificaciones es increíblemente estrecho debido a la corta duración de sus cadenas proteicas”, explicó el primer autor Denis Yudin, estudiante de doctorado en el laboratorio de Nenad Ban. “NAC garantiza que la enzima correcta esté en el lugar correcto en el momento preciso”.
Los conocimientos estructurales abren posibilidades para las terapias #
Otros estudios muestran que la enzima que modifica las proteínas histonas con grupo acetilo, HAT, se produce con frecuencia en exceso en ciertos tipos de cáncer, lo que altera la regulación genética y promueve el crecimiento tumoral. Por lo tanto, el control de NACA sobre el acceso de la enzima HAT al ribosoma podría proporcionar nuevos conocimientos sobre la biología tumoral.
La información estructural detallada sobre NACA y las enzimas que recluta, incluyendo cómo el HAT se une a uno de los brazos flexibles de NACA, podría abrir el camino a nuevas estrategias terapéuticas. Estas incluyen fármacos que bloquean la superficie de interacción de HAT o impiden su reclutamiento a los ribosomas traductores. Otras enfermedades derivadas de un procesamiento defectuoso durante la traducción en curso también podrían beneficiarse de estos hallazgos.
Una comprensión fundamentalmente cambiada de la biosíntesis de proteínas #
“Los nuevos hallazgos cambian nuestra visión de la síntesis de proteínas”, explicó Ban. “Muestran cuán coordinados y dinámicos son los procesos en el ribosoma, y cómo un pequeño complejo en la salida del túnel marca el ritmo de una gran fracción de la producción de proteínas en nuestras células”.
Las perspectivas también significan que los esfuerzos futuros para lograr una comprensión más profunda de la formación de proteínas deben necesariamente tener en cuenta la función del NAC. “También apuntan a un campo de investigación más amplio que emerge en mi laboratorio: la cuestión de cómo NACA integra la orientación co-traduccional, la modificación enzimática, el plegamiento de proteínas y el ensamblaje en un sistema coordinado”.
En este sentido, NACA se comporta menos como un andamio pasivo y más como un guardián molecular. “Al abrir o cerrar selectivamente el acceso al ribosoma dependiendo del tipo de proteína que se está sintetizando, el NAC actúa como un clasificador notablemente preciso que, sin embargo, obedece completamente los principios de la termodinámica”, dijo el profesor de ETH.
Citas #
-
El estudio Mechanism of cotranslational modification of histones H2A and H4 by MetAP1 and NatD fue publicado en Science Advances. Autores: Denis Yudin, Mateusz Jaskolowski, Ziyi Fan, Nicolas Burg, Sowmya Chandrasekar, Alfred M. Lentzsch, Alain Scaiola, Adrian Bothe, Elke Deuerling, Martin Gamerdinger, Shu-ou Shan & Nenad Ban.
-
El estudio NAC guides a ribosomal multienzyme complex for nascent protein processing fue publicado en Nature. Autores: Alfred M. Lentzsch, Denis Yudin, Martin Gamerdinger, Sowmya Chandrasekar, Laurenz Rabl, Alain Scaiola, Elke Deuerling, Nenad Ban & Shu-ou Shan.
-
El estudio NAC controls cotranslational N-terminal methionine excision in eukaryotes fue publicado en Science. Autores: Martin Gamerdinger, Min Jia, Renate Schloemer, Laurenz Rabl, Mateusz Jaskolowski, Katrin M. Khakzar, Zeynel Ulusoy, Annalena Wallisch, Ahmad Jomaa, Gundula Hunaeus, Alain Scaiola, Kay Diederichs, Nenad Ban & Elke Deuerling.
-
El estudio Mechanism of signal sequence handover from NAC to SRP on ribosomes during ER-protein targeting fue publicado en Science. Autores: Ahmad Jomaa, Martin Gamerdinger, Hao-Hsuan Hsieh, Annalena Wallisch, Viswanathan Chandrasekaran, Zeynel Ulusoy, Alain Scaiola, Ramanujan S. Hegde, Shu-ou Shan, Nenad Ban & Elke Deuerling
